吉林專注藥物安全性評價研究
藥物安全性評價的地位和價值體現在以下三個方面:1.在支持新藥臨床研究時,并不需要在進入臨床研究(I期)前完成所有相關研究,而是分階段來分別支持I、Ⅱ、Ⅲ期臨床研究,為如何進行臨床研究提供重要參考,具體體現在臨床研究方案中的給藥劑量(尤其是I期臨床研究的起始劑量)、安全性檢查/監測指標和檢測時機的確定,危險性的預測和救治措施的實施等方面;2.在臨床研究過程中,甚至上市后,出現非預期重要的安全性問題且難以判斷/預測其風險性等情況下,需再次進行有關的非臨床安全性研究(包括機制研究),通過臨床研究信息為非臨床安全性研究提供方向和目標,以減少臨床研究和(或)臨床應用的風險;3.在臨床研究完成后,受試藥的臨床有效性和安全性已有一個基本結論,此時藥物安全性評價的某些結果(如致*性等)可能是比較終確定受試藥是否批準上市(利弊權衡)的重要依據之一。設備設施、研究條件、人員資格與職責、操作過程等的嚴格要求,來保證藥物安全性評價數據的真實和可靠。吉林專注藥物安全性評價研究
藥物安全性是導致藥物研發失敗的重要因素,也是上市藥物退市的主要原因。傳統上藥物的毒性測試及安全性評價一般在臨床前階段的動物試驗中完成,一旦發現藥物嚴重的毒性反應而導致研發失敗將造成巨大的經濟損失。在藥物研發的早期階段進行離子通道、細胞水平上的藥物毒性測試將明顯降低后期藥物研發失敗的機率,從而降低研發成本。我們可以為客戶提供體外早期毒性篩選到體內早期毒性評價的完整策略,幫助我們的客戶在藥物研發的早期發現研發化合物的毒性作用。單次及反復給藥的毒性篩選實驗:個性化設計、快速、高效并準確的預測體內藥物毒性及毒靶;可在小動物上開展。遼寧值得信賴藥物安全性評價檢測英瀚斯生物專業為客戶提供藥物安全性評價!
世界監管科學促進創新藥發展舉措收到實效:(1)通過新藥評審溝通活動,促進藥物開發;(2)促進在藥物開發過程中與臨床試驗發起人交流;(3)促進生物標志物與藥物基因組學應用,促進以患者報告和其他重點評價工具開發;(4)促進罕見病藥物開發;(5)在新藥審評中使用風險效益評價工具;(6)以患者為中心的藥物開發項目,召開相關會議公布總結報告;(7)藥品安全體系現代化,評價風險評估與減低策略(REMS)的實施效果,促進REMS標準化以進一步融入醫療保健體系;(8)通過主動監測體系開展藥物安全性評價,促進藥物警戒現代化;(9)提交eCTD文件提高效率,提高藥品審評效率;(10)加速新藥審評,促進新藥和原創性生物大分子藥審評透明度與溝通交流項目,以促進創新藥審評審批。
參照創新型化藥審評實踐[]與國外同類品種技術要求,對于創新型抗體藥物的藥學研究與評價的一般原則如下:在保證藥物安全性評價的前提下,基于科學與風險的評估(science-andrisk-basedapproach),藥學研究應按照早期臨床試驗、關鍵性臨床試驗和申請上市等不同時間節點分階段進行要求。對于創新型抗體藥學研究的審評要點,除了滿足一般重組單抗藥物的基本要求外,還應結合其分子結構、作用機制的“新”特點進行特殊要求。下文擬結合國內外創新型抗體**品種的藥學評價實踐,對上述觀點進一步闡述。體外模型可輔助進行藥物安全性評價。
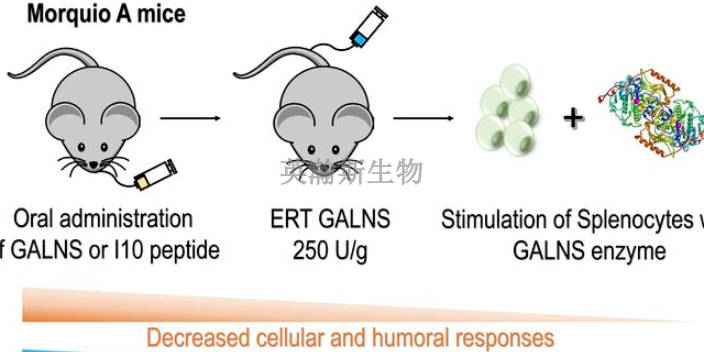
藥物安全性評價把握藥理毒理學研究的整體性:新藥非臨床安全性研究是新藥研發系統中的一個有機整體。不能把某一個毒理研究與其他毒理研究和藥理學、藥代動力學研究割裂開來,試驗設計時應充分考慮其它藥理毒理研究的研究結果。例如,為了使一個較長期重復給藥的毒理試驗得以成功,往往需要參考急性毒性、一般藥理和藥代動力學研究和短期重復給藥試驗結果等來對其進行合理設計;在評價方面,毒性研究的結果應該力求與其它藥理毒理試驗結果互為印證、說明和補充。例如,長毒試驗中性***的相關檢查可以一定程度上反映受試物對動物生殖功能的影響。一般藥理試驗中觀察到的不良反應可以與長毒試驗和急毒試驗的相互印證。目前國內普遍存在研究總體設計和實施的整體差的問題,直接影響了非臨床安全性評價的質量。為了解決這個問題,需要研究者,尤其是課題負責人加強對非臨床安全性研究整體性的認識,并在具體實施過程中進行總體把握。英瀚斯生物具備藥物安全性評價配套動物實驗室、細胞實驗室。甘肅比較好的藥物安全性評價研究
藥物安全性評價,是指利用實驗動物進行的一系列實驗研究,主要觀察和測定藥物對機體的損害和影響。吉林專注藥物安全性評價研究
首先,非臨床安全性研究在支持創新藥的臨床研究時并不是在進入臨床研究(I期)前完成所有相關研究,而是分階段來分別支持I、II、III期臨床研究,并為如何進行臨床研究提供重要參考,具體體現在臨床研究方案中的給藥劑量(尤其是I期臨床研究的起始劑量)、安全性檢查/監測指標和檢測時機的確定,危險性的預測和救治措施的實施等方面。其次,在臨床研究過程中甚至上市后出現非預期重要的安全性問題且難以判斷/預測其風險性等情況下,可能也需要再次進行有關的非臨床安全性研究(包括機理研究),如此由臨床研究信息來為非臨床安全性研究提供的方向和目標,以期減少臨床研究和/或臨床應用的風險。其三,在臨床研究完成后,對受試藥的臨床有效性和安全性已有一個基本結論,此時非臨床安全性評價的某些結果(如致*性等)可能是確定受試藥是否能批準上市(利弊權衡)的重要依據之一。吉林專注藥物安全性評價研究
- 陜西專注藥物安全性評價實驗 2025-07-01
- 吉林專注藥物安全性評價研究 2025-07-01
- 青海有什么藥物安全性評價實驗 2025-07-01
- 推薦的藥物安全性評價機構 2025-07-01
- 廣東專業藥物安全性評價 2025-07-01
- 江西高質量藥物安全性評價檢測 2025-06-30
- 北京比較好的藥物安全性評價研究 2025-06-30
- 江西靠譜免疫組化可以做什么 2025-06-30
- 西藏推薦的子宮內膜異位癥模型 2025-06-30
- 甘肅切片免疫組化外包 2025-06-30
- 安慶手指假肢電話 2025-07-01
- 遼寧取石網籃怎么樣 2025-07-01
- 同濟生物木果油廠家供應 2025-07-01
- 安徽哪里有灌腸器加盟 2025-07-01
- 山東國內醫用刻錄機24小時服務 2025-07-01
- 吉林品質蛋白質組學自動化設備 2025-07-01
- 青海病癥蛋白標志物 2025-07-01
- 浙江哪里找國產益生菌類型 2025-07-01
- 河南定制兒童義眼清洗 2025-07-01
- 衡陽高分子生物涂層效果 2025-07-01